Aktīvās sastāvdaļas: Degarelikss
FIRMAGON 80 mg pulveris un šķīdinātājs injekciju šķīduma pagatavošanai
Firmagon iepakojuma ieliktņi ir pieejami šādu izmēru iepakojumiem:- FIRMAGON 80 mg pulveris un šķīdinātājs injekciju šķīduma pagatavošanai
- FIRMAGON 120 mg pulveris un šķīdinātājs injekciju šķīduma pagatavošanai
Kāpēc lieto Firmagon? Kam tas paredzēts?
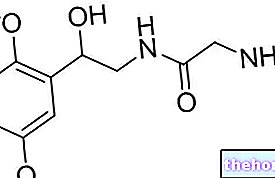
FIRMAGON satur degareliksu. Degarelikss ir ķīmiski sintezēts hormonu blokators, ko lieto prostatas vēža ārstēšanai pieaugušiem vīriešiem. Degarelikss imitē dabisko hormonu (gonadotropīnu atbrīvojošo hormonu, GnRH) un tieši bloķē tā iedarbību. To darot, degarelikss nekavējoties samazina vīriešu hormona testosterona līmeni, kas stimulē prostatas vēzi.
Kontrindikācijas Kad Firmagon nedrīkst lietot
Nelietojiet FIRMAGON - ja Jums ir alerģija pret degareliksu vai kādu citu šo zāļu sastāvdaļu.
Piesardzība lietošanā Kas jāzina pirms Firmagon lietošanas
Pastāstiet ārstam, ja Jums ir šādi nosacījumi:
- Jums ir kādi sirds un asinsvadu vai sirds ritma traucējumi (aritmija) vai lietojat zāles šīs problēmas ārstēšanai. Sirds ritma problēmas var saasināt, lietojot FIRMAGON.
- Jūs ciešat no cukura diabēta. Var pasliktināties vai attīstīties diabēts. Ja Jums ir diabēts, Jums biežāk jāmēra glikozes līmenis asinīs.
- Cieš no aknu darbības traucējumiem. Jums var būt nepieciešams pārbaudīt aknu darbību.
- Jūs ciešat no nieru slimībām. FIRMAGON lietošana nav pētīta pacientiem ar smagu nieru slimību.
- Jums ir osteoporoze vai kāds cits stāvoklis, kas ietekmē kaulu stiprumu. Samazināts testosterona līmenis var izraisīt kalcija samazināšanos kaulos (kaulu retināšanu).
- Cieš no paaugstinātas jutības. FIRMAGON lietošana nav pētīta pacientiem ar smagām paaugstinātas jutības reakcijām.
Bērni un pusaudži
Nedodiet šīs zāles bērniem vai pusaudžiem.
Mijiedarbība Kādas zāles vai pārtikas produkti var mainīt Firmagon iedarbību
FIRMAGON var ietekmēt dažas zāles, ko lieto sirds ritma traucējumiem (piemēram, hinidīnu, prokainamīdu, amiodaronu un sotalolu), vai citas zāles, kas var ietekmēt sirds ritmu (piemēram, metadonu (lieto sāpju mazināšanai un kā daļu no narkotiku atkarības detoksikācijas), moksifloksacīnu ( antibiotika), antipsihotiskie līdzekļi).
Pastāstiet ārstam par visām zālēm, kuras lietojat pēdējā laikā, esat lietojis vai varētu lietot, ieskaitot zāles, ko var iegādāties bez receptes.
Brīdinājumi Ir svarīgi zināt, ka:
Tiem, kas nodarbojas ar sporta aktivitātēm
Zāļu lietošana bez terapeitiskas nepieciešamības ir dopings un jebkurā gadījumā var noteikt pozitīvus antidopinga testus.
Transportlīdzekļu vadīšana un mehānismu apkalpošana
Nogurums un reibonis ir biežas blakusparādības, kas var ietekmēt spēju vadīt transportlīdzekļus un apkalpot mehānismus. Šīs sekas var būt saistītas ar ārstēšanu vai pašu slimību.
Deva, lietošanas veids un laiks Kā lietot Firmagon: Devas
Šīs zāles parasti jāievada ārstam vai medmāsai.
Ieteicamā sākuma deva ir divas 120 mg injekcijas pēc kārtas. Pēc tam Jums tiks ievadīta 80 mg injekcija mēnesī. Injicētais šķidrums veido želeju, kas viena mēneša laikā atbrīvo degareliksu.
FIRMAGON jāinjicē TIKAI zem ādas (subkutāni). FIRMAGON nedrīkst injicēt asinsvadā (intravenozi). Jāizmanto piesardzības pasākumi, lai izvairītos no nejaušas injekcijas vēnā. Injekcijas punkts ir jāmaina vēdera rajonā.
Ja esat aizmirsis lietot FIRMAGON
Ja domājat, ka esat aizmirsis savu FIRMAGON ikmēneša devu, lūdzu, informējiet par to savu ārstu. Ja jums ir kādi jautājumi par šo zāļu lietošanu, jautājiet savam ārstam.
Norādījumi pareizai lietošanai
PIEZĪME:
NEKratiet flakonus
Iepakojumā ir flakons ar pulveri un pilnšļirce ar šķīdinātāju, kas jāsagatavo subkutānai injekcijai.
- Noņemiet vāciņu no flakona adaptera iepakojuma. Pievienojiet adapteri pulvera flakonam, nospiežot uz leju, līdz gals iziet cauri gumijas aizbāzni un adapteris nofiksējas vietā.
- Sagatavojiet pilnšļirci, ievietojot virzuli
- Noņemiet pilnšļirces vāciņu. Pievienojiet šļirci pulvera flakonam, pieskrūvējot to pie adaptera.Pārnesiet visu šķīdinātāju uz pulvera flakonu.
- Turot šļirci ievietotu adapterī, viegli virpiniet, līdz šķidrums ir dzidrs un tajā nav nešķīstošu daļiņu vai pulvera. Ja pulveris pielīp flakonam virs šķidruma virsmas, flakonu var nedaudz noliekt. Kratot, lai novērstu putu veidošanos. ir pieņemams nelielu gaisa burbuļu gredzens uz šķidruma virsmas. Šķīdināšanas procedūra parasti ilgst dažas minūtes, bet dažos gadījumos tā var ilgt pat 15 minūtes.
- Pagrieziet flakonu otrādi un velciet līdz injekcijas šļirces marķējuma līnijai. Vienmēr pārliecinieties, lai izsūknētu precīzu tilpumu un pielāgotos burbuļiem.
- Atvienojiet šļirci no adaptera un ievietojiet šļircē dziļo zemādas injekcijas adatu.
- Ievadiet dziļu subkutānu injekciju. Lai to izdarītu: satveriet vēdera ādu, paceliet zemādas audus un dziļi ievietojiet adatu ne mazāk kā 45 grādu leņķī. Tūlīt pēc izšķīdināšanas lēnām injicējiet 4 ml FIRMAGON 80 mg. *
- Injekcijas nedrīkst veikt vietās, kur pacients var tikt pakļauts spiedienam, piemēram, jostas zonā, kur ir joslas vai ribu tuvumā. Neinjicējiet tieši vēnā. Viegli pavelciet šļirces virzuli atpakaļ, lai pārbaudītu, vai asinis ir iesūknētas. Ja šļircē ir asinis, zāles vairs nedrīkst lietot, pārtrauciet procedūru un izmetiet šļirci un adatu (izšķīdiniet pacientam jaunu devu).
* Ir pierādīta ķīmiski fizikālā stabilitāte, lietojot 2 stundas 25 ° C temperatūrā. No mikrobioloģiskā viedokļa, ja vien šķīdināšanas metode neizslēdz baktēriju piesārņojuma risku, produkts jāizlieto nekavējoties. Ja to neizmanto nekavējoties, par lietošanas laiku un nosacījumiem ir atbildīgs lietotājs.
Blakusparādības Kādas ir Firmagon blakusparādības?
Tāpat kā citas zāles, šīs zāles var izraisīt blakusparādības, kaut arī ne visiem tās izpaužas.
Smagas alerģiskas reakcijas pret šo narkotiku ir reti. Steidzami sazinieties ar savu ārstu, ja Jums rodas smagi izsitumi, nieze, elpas trūkums vai grūtības. Tie var būt smagas alerģiskas reakcijas simptomi.
Ļoti bieži (var skart vairāk nekā 1 no 10 lietotājiem)
Sārtums, sāpes un apsārtums injekcijas vietā. Blakusparādības injekcijas vietā ir biežāk sastopamas, lietojot sākuma devu, un retāk - ar uzturošo devu.
Bieži (var skart līdz 1 no 10 lietotājiem)
- pietūkums, mezgliņi un sacietējumi injekcijas vietā
- drebuļi, drudzis vai gripai līdzīgs sindroms pēc injekcijas
- miega traucējumi, nogurums, reibonis, galvassāpes
- svara pieaugums, slikta dūša, caureja, dažu aknu enzīmu līmeņa paaugstināšanās
- pārmērīga svīšana (ieskaitot nakts svīšanu), izsitumi
- anēmija
- sāpes un muskuļu un skeleta sistēmas slimības
- sēklinieku tilpuma samazināšanās, krūšu pietūkums, impotence.
Retāk (var skart līdz 1 no 100 lietotājiem)
- dzimumtieksmes zudums, sēklinieku sāpes, iegurņa sāpes, ejakulācijas mazspēja, dzimumorgānu kairinājums, sāpes krūtīs
- depresija, psihiskas izmaiņas
- ādas apsārtums, matu izkrišana, ādas mezgliņi, nejutīgums
- alerģiskas reakcijas, nātrene, nieze
- samazināta ēstgriba, aizcietējums, vemšana, sausa mute, sāpes vēderā un diskomforts, paaugstināts cukura līmenis asinīs / cukura diabēts, paaugstināts holesterīna līmenis, izmaiņas kalcija asinīs, svara samazināšanās
- paaugstināts asinsspiediens, sirds ritma izmaiņas, EKG izmaiņas (QT pagarināšanās), patoloģiskas sirdsdarbības sajūta, aizdusa, perifēra tūska
- muskuļu vājums, muskuļu spazmas, locītavu pietūkums / stīvums, osteoporoze / osteopēnija, locītavu sāpes
- bieža vēlme urinēt, vēlme urinēt, grūtības vai sāpes urinēšanā, urinēšana naktī, nieru darbības traucējumi, nesaturēšana
- neskaidra redze
- diskomforts injekcijas vietā, ieskaitot asinsspiediena pazemināšanos un sirdsdarbības ātrumu (vazovagāla reakcija)
- savārgums
Reti (var skart līdz 1 no 1000 lietotājiem)
- Febrila neitropēnija (ļoti zems balto asins šūnu skaits kombinācijā ar drudzi) sirdslēkme, sirds mazspēja.
Ļoti reti (var skart līdz 1 no 10 000 lietotājiem)
- Infekcija, abscess un nekroze injekcijas vietā
Ziņošana par blakusparādībām
Ja Jums rodas jebkādas blakusparādības, konsultējieties ar ārstu, ieskaitot visas iespējamās blakusparādības, kas nav minētas šajā instrukcijā. Jūs varat ziņot par blakusparādībām arī tieši, izmantojot valsts ziņošanas sistēmu.
Ziņojot par blakusparādībām, jūs varat palīdzēt iegūt vairāk informācijas par šo zāļu drošumu.
Derīguma termiņš un saglabāšana
Uzglabāt šīs zāles bērniem neredzamā un nepieejamā vietā.
Nelietot šīs zāles pēc derīguma termiņa beigām, kas norādīts uz flakoniem, šļircēm un kastītes. Derīguma termiņš attiecas uz norādītā mēneša pēdējo dienu.
Šīm zālēm nav nepieciešami īpaši uzglabāšanas noteikumi.
Pēc izšķīdināšanas
Šīs zāles ir stabilas 2 stundas 25 ° C temperatūrā.
Ņemot vērā mikrobu piesārņojuma risku, šīs zāles jāizlieto nekavējoties. Ja zāles netiek izlietotas nekavējoties, par šo zāļu lietošanu ir atbildīgs lietotājs.
Neizmetiet zāles kanalizācijā vai sadzīves atkritumos. Jautājiet farmaceitam, kā izmest zāles, kuras vairs nelietojat. Tas palīdzēs aizsargāt vidi.
Cita informācija
Ko FIRMAGON satur
- Aktīvā viela ir degarelikss. Katrs flakons satur 80 mg degareliksa (acetāta veidā). Pēc izšķīdināšanas 1 ml pagatavotā šķīduma satur 20 mg degareliksa
- Cita pulvera sastāvdaļa ir mannīts (E421).
- Šķīdinātājs ir ūdens injekcijām.
Kā izskatās FIRMAGON kastīte un ko tā satur
FIRMAGON ir pulveris un šķīdinātājs injekciju šķīduma pagatavošanai. Pulverim ir balts vai gandrīz balts izskats. Šķīdinātājs ir dzidrs, bezkrāsains šķīdums.
FIRMAGON ir pieejams divos iepakojumos.
Iepakojumā 1 paplāte, kurā ir: 1 flakons ar pulveri, kas satur 80 mg degareliksa, un 1 pilnšļirce, kas satur 4,2 ml šķīdinātāja, 1 virzulis, 1 flakona adapteris un 1 injekcijas adata.
Iepakojumā 3 paplātes, kas satur: 3 flakonus ar pulveri, kas satur 80 mg degareliksa, un 3 pilnšļirces, kas satur 4,2 ml šķīdinātāja, 3 virzuļus, 3 flakonu adapterus un 3 injekciju adatas.
Ne visi iepakojumi var būt pārdošanā.
Avota lietošanas instrukcija: AIFA (Itālijas zāļu aģentūra). Saturs publicēts 2016. gada janvārī. Pašlaik pieejamā informācija var nebūt atjaunināta.
Lai piekļūtu visjaunākajai versijai, ieteicams piekļūt AIFA (Itālijas zāļu aģentūra) vietnei. Atruna un noderīga informācija.
01.0 ZĀĻU NOSAUKUMS
FIRMAGON 80 MG pulveris un šķīdinātājs nešķīstošam šķīdumam
02.0 KVALITATĪVAIS UN KVANTITATĪVAIS SASTĀVS
Katrs flakons satur 80 mg degareliksa (acetāta formā).
Pēc izšķīdināšanas katrs ml šķīduma satur 20 mg degareliksa.
Pilnu palīgvielu sarakstu skatīt apakšpunktā 6.1.
03.0 ZĀĻU FORMA
Pulveris un šķīdinātājs injekciju šķīduma pagatavošanai.
Pulveris: balts vai gandrīz balts pulveris.
Šķīdinātājs: dzidrs, bezkrāsains šķīdums.
04.0 KLĪNISKĀ INFORMĀCIJA
04.1 Terapeitiskās indikācijas
FIRMAGON ir gonadotropīnu atbrīvojošā hormona (GnRH) antagonists, kas paredzēts pieaugušu vīriešu dzimuma pacientu ārstēšanai ar progresējošu no hormoniem atkarīgu prostatas vēzi.
04.2 Devas un lietošanas veids
Devas
Pirmā uzturošā deva jāievada mēnesi pēc sākotnējās devas.
Degareliksa terapeitiskais efekts jāuzrauga, izmantojot klīniskos parametrus un prostatas specifiskā antigēna (PSA) līmeni serumā. Klīniskie pētījumi ir parādījuši, ka testosterona (T) līmeņa nomākums notiek tūlīt pēc sākotnējās devas ievadīšanas, un testosterona līmenis serumā atbilst medicīniskās kastrācijas līmenim (Ttestosterons (T
Pacientiem ar neoptimālu atbildes reakciju jāapstiprina, ka testosterona līmenis serumā joprojām ir pietiekami samazināts.
Tā kā degarelikss neizraisa testosterona līmeņa paaugstināšanos, nav nepieciešams kombinēt antiandrogēnu kā aizsardzību pret palielināšanos terapijas sākumā.
Īpašas populācijas
Gados vecāki cilvēki, pacienti ar aknu vai nieru darbības traucējumiem:
Gados vecākiem cilvēkiem vai pacientiem ar viegliem vai vidēji smagiem aknu vai nieru darbības traucējumiem deva nav jāpielāgo (skatīt apakšpunktu 5.2). Nav veikti pētījumi ar pacientiem ar smagiem aknu vai nieru darbības traucējumiem, tāpēc ieteicams to ievērot piesardzīgi (skatīt apakšpunktu 4.4).
Pediatriskā populācija
FIRMAGON nav īpaši lietots bērniem un pusaudžiem, lai ārstētu pieaugušos vīriešus ar hormonu atkarīgu prostatas vēzi.
Lietošanas veids
Pirms ievadīšanas FIRMAGON jāizšķīdina. Norādījumus par sagatavošanu un ievadīšanu skatīt 6.6.
FIRMAGON paredzēts TIKAI subkutānai lietošanai, nelietojiet intravenozi.
Intramuskulāra ievadīšana nav ieteicama, jo tā nav pētīta.
FIRMAGON ievada zemādas injekcijas veidā vēdera rajonā. Injekcijas vieta periodiski jāmaina. Injekcijas jāveic vietās, kur nav spiediena, piemēram, prom no jostām vai elastīgajām joslām, nevis blakus ribām.
04.3 Kontrindikācijas
Paaugstināta jutība pret aktīvo vielu vai kādu no palīgvielām, kas uzskaitītas 6. apakšpunktā.
04.4 Īpaši brīdinājumi un piesardzība lietošanā
Ietekme uz QT / QTc intervālu
Ilgstoša androgēnu atņemšanas terapija var pagarināt QT intervālu. Apstiprinošā pētījumā, kurā salīdzināja FIRMAGON ar leuprorelīnu, tika veiktas periodiskas (ikmēneša) novērošanas elektrokardiogrammas (EKG); abās terapijās tika novērots intervāls. QT / QTc vairāk nekā 450 ms aptuveni 20% pacientu un vairāk nekā 500 ms attiecīgi 1% un 2% pacientu degareliksa un leuprorelīna grupā (skatīt 5.1. apakšpunktu).
FIRMAGON nav pētīts pacientiem, kuriem anamnēzē koriģēts QT intervāls pārsniedz 450 ms, pacientiem ar anamnēzi vai torsades de pointes riska faktoriem, kā arī pacientiem, kuri vienlaicīgi lieto zāles, kas var pagarināt QT intervālu. Šādiem pacientiem rūpīgi jāapsver ārstēšanas ar FIRMAGON ieguvuma / riska attiecība (skatīt 4.5. un 4.8. apakšpunktu).
Rūpīgs QT pētījums parādīja, ka degareliksam nav būtiskas ietekmes uz QT / QTc intervālu (skatīt 4.8. Apakšpunktu).
Aknu darbības traucējumi
Pacienti ar zināmiem vai iespējamiem aknu darbības traucējumiem netika iekļauti ilgstošos degareliksa klīniskajos pētījumos. Tika novērots mērens, pārejošs ALAT un ASAT līmeņa paaugstināšanās, kam nebija pievienots bilirubīna līmeņa paaugstināšanās vai klīniskie simptomi. Pacientiem ar zināmiem vai iespējamiem aknu darbības traucējumiem ārstēšanas laikā ieteicams kontrolēt aknu darbību. Degareliksa farmakokinētika tika pētīta pēc vienreizējas intravenozas ievadīšanas pacientiem ar viegliem vai vidēji smagiem aknu darbības traucējumiem (skatīt 5.2. Apakšpunktu).
Nieru darbības traucējumi
Degarelikss nav pētīts pacientiem ar smagiem nieru darbības traucējumiem, tādēļ šādiem pacientiem ieteicams ievērot piesardzību.
Paaugstināta jutība
Degarelikss nav pētīts pacientiem, kuriem anamnēzē ir bijusi smaga neārstēta astma, anafilaktiskas reakcijas vai smaga nātrene vai angioneirotiskā tūska.
Kaulu blīvuma izmaiņas
Medicīnas literatūrā ziņots par kaulu blīvuma samazināšanās gadījumiem vīriešiem, kuriem tiek veikta orhiektomija vai kuri ārstēti ar GnRH agonistiem. Var pieņemt, ka ilgstoši testosterona līmeņa nomākšanas periodi cilvēkiem var ietekmēt kaulu blīvumu.Kaulu blīvums ārstēšanas laikā ar degareliksu nav mērīts.
Glikozes tolerance
Glikozes tolerances samazināšanās tika novērota vīriešiem, kuriem tika veikta orhiektomija vai kuri tika ārstēti ar GnRH agonistiem. Var novērot diabēta attīstību vai pasliktināšanos, tādēļ pacientiem ar cukura diabētu, veicot androgēnu atņemšanas terapiju, biežāk jākontrolē glikozes līmenis asinīs.Degareliksa ietekme uz insulīnu un glikozes līmeni nav pētīta.
Sirds un asinsvadu slimības
Pacientiem, kuriem tiek veikta androgēnu atņemšanas ārstēšana, literatūrā ir ziņots par sirds un asinsvadu slimībām, piemēram, insultu un miokarda infarktu. Tāpēc jāņem vērā visi sirds un asinsvadu riska faktori.
04.5 Mijiedarbība ar citām zālēm un citi mijiedarbības veidi
Oficiāli zāļu mijiedarbības pētījumi nav veikti.
Tā kā ārstēšana ar androgēnu atņemšanu var pagarināt QTc intervālu, rūpīgi jāapsver degareliksa lietošana vienlaikus ar zālēm, par kurām zināms, ka tās pagarina QTc intervālu, vai zālēm, kas var izraisīt torsade de pointes, piemēram, IA klases antiaritmiski līdzekļi, piemēram, hinidīns, disopiramīds). III (piemēram, amiodarons, sotalols, dofetilīds, ibutilīds), metadons, moksifloksacīns, antipsihotiskie līdzekļi utt. (Skatīt apakšpunktu 4.4).
Degarelikss nav cilvēka CYP450 sistēmas substrāts, un tam nav indukcijas vai inhibīcijas in vitro CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 vai CYP3A4 / 5. Tāpēc klīniski nozīmīga farmakokinētiskā mijiedarbība starp zālēm, kas saistītas ar iepriekš minētajiem izoenzīmiem, ir maz ticama.
04.6 Grūtniecība un zīdīšana
Grūtniecība un zīdīšanas periods
Nav norāžu par FIRMAGON lietošanu sievietēm.
Auglība
FIRMAGON var kavēt vīriešu auglību, kamēr testosterons ir nomākts.
04.7 Ietekme uz spēju vadīt transportlīdzekļus un apkalpot mehānismus
FIRMAGON neietekmē vai nedaudz ietekmē spēju vadīt transportlīdzekļus un apkalpot mehānismus. Nogurums un svārstības ir bieži sastopamas blakusparādības, kas var ietekmēt spēju vadīt transportlīdzekļus vai apkalpot mehānismus.
04.8 Nevēlamās blakusparādības
Drošības profila kopsavilkums
Visbiežāk novērotās nevēlamās blakusparādības degareliksa terapijas laikā apstiprinošos III fāzes pētījumos (N = 409) ir saistītas ar paredzamo testosterona nomākšanas fizioloģisko ietekmi, un tās ietver pietvīkumu un ķermeņa masas palielināšanos (novērotas attiecīgi 25% un 7% ārstēto pacientu). vienu gadu) vai blakusparādības injekcijas vietā. Ir ziņots par īslaicīgu drebuļu parādīšanos, drudzi vai gripai līdzīgiem simptomiem (attiecīgi 3%, 2% un 1% pacientu) stundu laikā pēc ievadīšanas.
Nevēlamās reakcijas injekcijas vietā galvenokārt bija sāpes un eritēma, par kurām ziņots attiecīgi 28%un 17%pacientu, retāk ziņots par pietūkumu (6%), sacietēšanu (4%) un gabaliņu veidošanos (3).%). Šie notikumi notika galvenokārt ar sākuma devu, savukārt uzturošās terapijas laikā, lietojot 80 mg devu, šo notikumu biežums uz 100 injekcijām bija 3: sāpes un abscess injekcijas vietā vai nekroze injekcijas vietā, kam var būt nepieciešama ķirurģiska ārstēšana / drenāža.
Blakusparādību tabula
Turpmāk uzskaitīto nevēlamo blakusparādību biežums ir noteikts saskaņā ar šādiem noteikumiem:
Ļoti bieži (≥ 1/10); bieži (≥ 1/100 e
1. tabula. Nevēlamo blakusparādību biežums, kas ziņots 1259 pacientiem, kas gada laikā kopā ārstēti 1781 pacientam (II un III fāzes pētījumi) un pēcreģistrācijas ziņojumiem
* Zināmas testosterona nomākšanas fizioloģiskās sekas
Izvēlēto blakusparādību apraksts
Laboratorijas parametru izmaiņas
Laboratorisko parametru izmaiņas, kas novērotas viena ārstēšanas gada laikā apstiprinošā III fāzes pētījumā (N = 409), bija vienādas gan degareliksa, gan GnRH agonistu (leuprorelīna) salīdzinošajā grupā. Ievērojami patoloģiskas aknu transamināžu (ALAT, ASAT un GGT) vērtības (> 3 * ULN) tika novērotas 2-6% pacientu ar normālām vērtībām ārstēšanas sākumā pēc terapijas ar abām zālēm. vērtības pirms ārstēšanas, ievērojams hematoloģisko vērtību, hematokrīta (≤0,37) un hemoglobīna (≤115 g / l) samazinājums tika novērots attiecīgi 40% un 13-15% pēc ārstēšanas ar abām zālēm. kas nosaka šo hematoloģisko vērtību samazināšanos, ir saistīta ar pamata patoloģiju vai ir androgēnu atņemšanas terapijas sekas. Izteikti patoloģiskas kālija vērtības
(≥5,8 mmol / L), kreatinīns (≥177 μmol / L) un BUN (≥10,7 mmol / l) pacientiem ar normālu pirms ārstēšanas vērtību tika novēroti attiecīgi 6%, 2%un 15%. pacientiem, kuri tika ārstēti ar degareliksu un
3%, 2% un 14% pacientu, kas ārstēti ar leuprorelīnu.
Izmaiņas EKG vērtībās
Izmaiņas EKG mērījumos, kas novērotas viena ārstēšanas gada laikā apstiprinošā III fāzes pētījumā (N = 409), bija vienādas gan degareliksa, gan
ārstēja ar GnRH agonistu (leuprorelīnu) kā salīdzinošo līdzekli. Trīs pacienti (500 ms. No sākuma līdz pētījuma beigām vidējās QTcF izmaiņas bija 12,0 ms degareliksa grupā un 16,7 ms leuprorelīna grupā.
Degareliksa raksturīgās ietekmes trūkums uz sirds repolarizāciju (QTcF), sirdsdarbības ātrumu, AV vadīšanu, sirds depolarizāciju vai T vai U viļņu morfoloģiju tika apstiprināts ar rūpīgu QT pētījumu veseliem cilvēkiem (N = 80), kuri saņēma "IV infūziju" degareliksa 60 minūšu laikā, sasniedzot vidējo Cmax 222 ng / ml, kas ir aptuveni 3-4 reizes lielāks par Cmax, kas iegūts prostatas vēža ārstēšanas laikā.
Ziņošana par iespējamām blakusparādībām
Ir svarīgi ziņot par iespējamām blakusparādībām pēc zāļu reģistrācijas, jo tas ļauj nepārtraukti uzraudzīt zāļu ieguvuma un riska attiecību. Veselības aprūpes speciālistus lūdz ziņot par visām iespējamām blakusparādībām, izmantojot valsts ziņošanas sistēmu. " .
04.9 Pārdozēšana
Nav klīniskas pieredzes par akūtas degareliksa pārdozēšanas ietekmi. Pārdozēšanas gadījumā pacients rūpīgi jānovēro un, ja uzskata par nepieciešamu, jāveic atbalstoša terapija.
05.0 FARMAKOLOĢISKĀS ĪPAŠĪBAS
05.1 Farmakodinamiskās īpašības
Farmakoterapeitiskā grupa: endokrīnā terapija, citi hormonu antagonisti un līdzīgas vielas.
ATĶ kods: L02BX02.
Darbības mehānisms
Degarelikss ir selektīvs gonadotropīnu atbrīvojošā hormona (GnRH) antagonists, kas konkurētspējīgi un atgriezeniski saistās ar hipofīzes GnRH receptoriem, tādējādi strauji samazinot gonadotropīnu, luteinizējošā hormona (LH) un folikulu stimulējošā hormona (FSH) izdalīšanos, kā rezultātā samazinās testosterona sekrēcija (T) ar sēkliniekiem. Ir zināms, ka prostatas vēzis ir jutīgs un reaģē uz ārstēšanu, kas novērš androgēnu avotu. Atšķirībā no GnRH agonistiem, GnRH antagonisti neizraisa LH palielināšanos, kā rezultātā palielinās testosterona / audzēja stimulācija un iespējami simptomātiski simptomi uzliesmojums pēc ārstēšanas uzsākšanas.
Viena 240 mg degareliksa deva, kam seko ikmēneša uzturošā deva 80 mg, izraisa strauju LH un FSH koncentrācijas un līdz ar to arī testosterona samazināšanos. Dihidrotestosterona (DHT) koncentrācija serumā samazinās tāpat kā testosterona. Degarelikss ir efektīvs, lai sasniegtu un uzturētu testosterona nomākumu krietni zem medicīniskās kastrācijas līmeņa 0,5 ng / ml. Mēneša uzturošā deva 80 mg ļauj saglabāt testosterona nomākumu 97% pacientu vismaz vienu gadu. Degareliksa terapijas laikā pēc injekcijām pēc pirmās injekcijas netika novērots maksimums. Vidējais testosterona līmenis pēc viena gada ārstēšanas bija 0,087 ng / ml (starpkvartilitātes diapazons 0,06-0,15) N = 167.
Apstiprinošā III fāzes pētījuma rezultāti
Degareliksa efektivitāte un drošība tika novērtēta atklātā, daudzcentru, randomizētā, aktīvās kontroles, paralēlas grupas pētījumā. Pētījumā tika novērtēta divu ikmēneša degareliksa dozēšanas shēmu efektivitāte un drošība, lietojot vienu sākuma devu 240 mg (40 mg / ml). ar ikmēneša subkutānu devu 160 mg (40 mg / ml) vai 80 mg (20 mg / ml), salīdzinot ar 7,5 mg leuprorelīna ievadīšanu ik mēnesi intramuskulāri pacientiem ar prostatas vēzi, kam nepieciešama androgēnu atņemšanas terapija. Kopumā trīs ārstēšanas grupās tika randomizēti 620 pacienti, no kuriem 504 (81%) pacienti pabeidza pētījumu. Degareliksa 240/80 mg grupā 41 (20%) pacientu pārtrauca pētījumu, salīdzinot ar 32 (16%) pacientiem leuprorelīna grupā.
No 610 ārstētajiem pacientiem:
• 31% bija lokalizēts prostatas vēzis
• 29% bija lokāli progresējis prostatas vēzis
• 20% bija metastātisks prostatas vēzis
• 7% bija metastātisks stāvoklis
• 13% pacientu iepriekš bija ārstēti ar operāciju vai starojumu vai tiem bija paaugstināts PSA.
Pamata demogrāfiskie dati visām grupām ir līdzīgi. Vidējais vecums bija 74 gadi (diapazons no 47 līdz 98 gadiem). Galvenais mērķis bija pierādīt degareliksa efektivitāti, lai sasniegtu un uzturētu testosterona nomākumu zem 0,5 ng / ml 12 ārstēšanas mēnešu laikā: Zemākā efektīvā uzturošā deva 80 mg tika izvēlēts degarelikss.
Testosterona (T) līmeņa sasniegšana serumā ≤0,5 ng / ml
FIRMAGON ir efektīvs, lai panāktu ātru testosterona nomākšanu, skatīt 2. tabulu.
2. tabula. To pacientu procentuālā daļa, kuri sasniedza T≤0,5 ng / ml pēc ārstēšanas uzsākšanas.
Izvairieties no pēkšņa testosterona līmeņa paaugstināšanās
Pēkšņs pieaugums tiek definēts kā sākotnējā testosterona līmeņa pārsniegšana ≥15% pirmajās divās nedēļās.
Nevienam ar degareliksu ārstētajam pacientam netika novērota pēkšņa testosterona līmeņa paaugstināšanās; vidējais testosterona samazinājums par 94% 3. dienā. Lielākajai daļai pacientu, kas tika ārstēti ar leuprorelīnu, bija paaugstināts testosterona līmenis, un 3. dienā vidējais testosterona līmeņa pieaugums bija par 65%. Šīs atšķirības bija statistiski nozīmīgas (p
Pētījuma primārais beigu punkts bija testosterona nomākuma ātrums pēc viena gada degareliksa vai leuprorelīna terapijas.Degareliksa klīniskais ieguvums salīdzinājumā ar ar antiandrogēnu saistīto leuprorelīnu agrīnā ārstēšanā netika pierādīts.
Testosterona līmeņa atjaunošana
Pētījumā, kurā piedalījās pacienti ar PSA paaugstināšanos pēc lokālas terapijas (galvenokārt radikāla prostatektomija un staru terapija), FIRMAGON tika ievadīts septiņu mēnešu periodā, kam sekoja septiņu mēnešu novērošanas periods. Vidējais laiks līdz testosterona līmeņa atjaunošanai (> 0,5 ng / ml, pārsniedzot kastrācijas līmeni) pēc ārstēšanas pārtraukšanas bija 112 dienas (aprēķināts no novērošanas perioda sākuma, t.i., 28 dienas pēc pēdējās injekcijas). Vidējais laiks, lai sasniegtu testosterona līmeni> 1,5 ng / ml (virs normas apakšējās robežas), bija 168 dienas.
Ilgtermiņa efektivitāte
Terapeitiskie panākumi pētījumā tika definēti kā medicīniskās kastrācijas līmeņa sasniegšana 28. dienā un testosterona koncentrācijas uzturēšana, kas nepārsniedz 0,5 ng / ml jebkurā no 364 ārstēšanas dienām.
3. tabula. Testosterona kumulatīvā varbūtība ≤0,5 ng / ml no 28. līdz 364. dienai.
* Kaplana Meiera aplēses grupām
Prostatas specifiskā antigēna (PSA) samazināšanas sasniegums
Audzēja lielums netika mērīts tieši klīniskā pētījuma laikā, bet netieša pozitīva audzēja reakcija bija pierādāma kā vidējais PSA samazinājums par 95%, lietojot degareliksu pēc 12 mēnešiem.
PSA vidējās vērtības sākotnējā pētījumā bija:
• 19,8 ng / ml (starpkvartilu diapazons: P25 9,4 ng / ml, P75 46,4 ng / ml) degareliksa 240/80 mg grupā
• 17,4 ng / ml (starpkvartilu diapazons: P25 8,4 ng / ml, P75 56,5 ng / ml) 7,5 mg leuprorelīna grupā.
Atšķirības ir statistiski nozīmīgas (lpp
Prostatas specifiskā antigēna (PSA) līmenis pēc divu nedēļu degareliksa lietošanas tika samazināts par 64%, pēc viena mēneša - par 85% un pēc trim mēnešiem - par 95%, paliekot nomākts (aptuveni 97%) uz vienu ārstēšanas periodu.
No 56.
Ietekme uz prostatas tilpumu
Trīs mēnešus ilga degareliksa terapija (240/80 mg devu shēma) izraisīja prostatas tilpuma samazināšanos par 37% pacientiem, kuriem pirms staru terapijas bija nepieciešama hormonu terapija, un pacientiem, kuriem bija nepieciešama medicīniska kastrācija. Prostatas tilpuma samazinājums bija līdzīgs tam, kas tika sasniegts, lietojot goserelīnu un antiandrogēnu aizsardzību.
Ietekme uz QT / QTc intervāliem
Kontroles elektrokardiogrammas periodiski tika veiktas apstiprinošā pētījumā, salīdzinot FIRMAGON ar leuprorelīnu. Izmantojot abas terapijas, QT / QTc intervāls, kas pārsniedz 450 ms, tika novērots aptuveni 20% pacientu. Sākot no pētījuma sākuma līdz pētījuma beigām, vidējās izmaiņas, kas izmērītas ar FIRMAGON, bija 12,0 ms un ar leuprorelīnu - 16,7 ms.
Anti-degareliksa antivielas
Anti-degareliksa antivielu veidošanās tika novērota 10% pacientu pēc viena gada ārstēšanas ar FIRMAGON un 29% pacientu pēc ārstēšanas ar FIRMAGON līdz 5,5 gadiem. Nav norāžu, ka šo antivielu veidošanās ietekmētu FIRMAGON efektivitāti un drošību līdz 5,5 ārstēšanas gadiem.
Pediatriskā populācija
Eiropas Zāļu aģentūra ir atbrīvojusi FIRMAGON no pienākuma iesniegt pētījumu rezultātus visās pediatriskās populācijas apakšgrupās (informāciju par lietošanu bērniem skatīt 4.2. Apakšpunktā).
05.2 Farmakokinētiskās īpašības
Uzsūkšanās
Pēc 240 mg degareliksa 40 mg / ml koncentrācijas subkutānas ievadīšanas pacientiem ar prostatas vēzi galvenajā pētījumā CS21 AUC0-28 dienas bija 635 (602-668) diena * ng / ml, Cmax bija 66,0 (61,0- 71,0) ng / ml un tika sasniegts pie Tmax 40 (37-42) stundām. Vidējās vērtības bija aptuveni 11-12 ng / ml pēc sākuma devas un 11-16 ng / ml pēc 80 mg uzturošās devas koncentrācijā 20 Cg / ml. Pēc C nogulsnes, kas veidojas injekcijas vietā. Zāļu farmakokinētisko uzvedību ietekmē tā koncentrācija injekciju šķīdumā. Tāpēc Cmax un biopieejamībai ir tendence samazināties, palielinoties devas koncentrācijai, bet pusperiodam ir tendence d palielināt. Tādēļ nedrīkst lietot citas stiprās devas, izņemot ieteicamās.
Izplatīšana
Izplatīšanās tilpums veseliem gados vecākiem vīriešiem ir aptuveni 1 l / kg. Tiek lēsts, ka saistīšanās ar plazmas olbaltumvielām ir aptuveni 90%.
Biotransformācija
Degarelikss bieži izjauc peptīdus, kad tas iziet cauri aknu un žults ceļu sistēmai, un galvenokārt izdalās ar peptīdiem fragmentos ar izkārnījumiem. Pēc subkutānas ievadīšanas plazmas paraugos netika konstatēti nozīmīgi metabolīti. Izglītība in vitro pierādīja, ka degarelikss nav cilvēka CYP450 sistēmas substrāts.
Eliminācija
Veseliem vīriešiem aptuveni 20-30% vienas intravenozas devas izdalās ar urīnu, kas liecina, ka 70-80% izdalās caur aknu un žults ceļu sistēmu. Degareliksa klīrenss, ievadot vienu intravenozu devu (0,864-49,4 mcg / kg) veseliem gados vecākiem vīriešiem, bija 35-50 ml / h / kg.
Īpašas populācijas:
Pacienti ar nieru darbības traucējumiem
Farmakokinētikas pētījumi pacientiem ar nieru darbības traucējumiem nav veikti. Tikai aptuveni 20-30% no ievadītās degareliksa devas izdalās caur nierēm nemainītā veidā. III fāzes apstiprinošā pētījuma populācijas farmakokinētiskā analīze parādīja, ka degareliksa klīrenss pacientiem ar viegliem vai vidēji smagiem nieru darbības traucējumiem ir samazinājies par aptuveni 23%; tādēļ šādiem pacientiem devas pielāgošana nav ieteicama. Dati par pacientiem ar smagiem nieru darbības traucējumiem ir ierobežoti un tāpēc šiem pacientiem ieteicams ievērot piesardzību.
Pacienti ar aknu darbības traucējumiem
Degareliksu novērtēja farmakokinētikas pētījumā pacientiem ar viegliem vai vidēji smagiem aknu darbības traucējumiem. Pacientiem ar aknu darbības traucējumiem, salīdzinot ar veseliem cilvēkiem, netika novērotas pārmērīgas iedarbības pazīmes. Pacientiem ar viegliem vai vidēji smagiem aknu darbības traucējumiem devas pielāgošana nav nepieciešama. Pacienti ar smagiem aknu darbības traucējumiem nav pētīti, tādēļ šajā grupā ieteicams ievērot piesardzību.
05.3 Preklīniskie drošības dati
Dzīvnieku reprodukcijas pētījumi parādīja, ka degarelikss izraisa vīriešu dzimuma dzīvnieku neauglību. Tas ir saistīts ar atgriezenisku farmakoloģisko efektu.
Reproduktīvās toksicitātes pētījumos ar mātītēm degarelikss deva gaidītos rezultātus, ņemot vērā tā farmakoloģiskās īpašības. Tas izraisa no devas atkarīgu pārošanās un grūtniecības laika pagarināšanos, neliels skaits corpora lutea, un pirms un pēc implantācijas zaudējumu pieaugums, aborti, agrīna embriju / augļa nāve, priekšlaicīgas dzemdības un dzemdību ilgums.
Preklīniskie farmakoloģiskās drošības pētījumi, atkārtotas toksicitātes, genotoksicitātes un kancerogēnas iedarbības pētījumi neuzrādīja īpašu risku cilvēku sugai. Jo īpaši abi pētījumi in vitro ka in vivo neuzrādīja QT pagarināšanos.
Akūtos, subakūtos vai hroniskos pētījumos ar žurkām un pērtiķiem pēc degareliksa subkutānas ievadīšanas netika novērota toksiska ietekme uz orgāniem. Lietojot degareliksu lielās devās subkutāni, tika novērots ar narkotikām saistīts lokāls kairinājums.
06.0 FARMACEITISKĀ INFORMĀCIJA
06.1 Palīgvielas
Putekļi
Mannīts (E421)
Šķīdinātājs
Ūdens injekcijām
06.2 Nesaderība
Ja nav saderības pētījumu, nesajauciet šo produktu ar citām zālēm.
06.3 Derīguma termiņš
3 gadi.
Pēc izšķīdināšanas
Ir pierādīta ķīmiski fizikālā stabilitāte, lietojot 2 stundas 25 ° C temperatūrā. No mikrobioloģiskā viedokļa, ja vien izšķīdināšanas metode neizslēdz baktēriju piesārņojuma risku, produkts jāizlieto nekavējoties. Ja tas netiek lietots nekavējoties, par lietošanas laikiem un nosacījumiem ir atbildīgs lietotājs.
06.4 Īpaši uzglabāšanas nosacījumi
Nav īpašu piesardzības pasākumu.
Izšķīdinātā produkta uzglabāšanas apstākļus skatīt apakšpunktā 6.3.
06.5 Tiešā iepakojuma veids un iepakojuma saturs
Stikla flakons (I tips) ar brombutila gumijas aizbāzni un noņemamu alumīnija aizbāzni, kas satur 80 mg pulvera injekciju šķīduma pagatavošanai
Pilnšļirce (I tips) ar elastomēra virzuli, vāciņu un 4 ml marķējuma līniju, kas satur 4,2 ml šķīdinātāja
Virzulis
Flakona adapteris
Injekcijas adata (25G 0,5 x 25mm)
Iepakojums FIRMAGON ir pieejams divos iepakojumos:
Iepakojumā 1 paplāte, kurā ir: 1 flakons ar pulveri, 1 pilnšļirce ar šķīdinātāju, 1 virzulis, 1 flakona adapteris un 1 adata.
Iepakojumā 3 paplātes, kas satur: 3 flakonus ar pulveri, 3 pilnšļirces ar šķīdinātāju, 3 virzuļus, 3 flakonu adapterus un 3 adatas.
Ne visi iepakojuma izmēri var būt tirgū.
06.6 Norādījumi lietošanai un lietošanai
Uzmanīgi ievērojiet šķīdināšanas norādījumus.
Nav ieteicams ievadīt dažādas koncentrācijas, jo koncentrācija ietekmē gēla nogulšņu veidošanos. Pagatavotajam šķīdumam jābūt dzidram šķidrumam, bez izšķīdinātām daļiņām.
PIEZĪME:
• NEKratiet flakonus
Iepakojumā ir flakons ar pulveri un pilnšļirce ar šķīdinātāju, kas jāsagatavo subkutānai injekcijai.
1. Noņemiet vāciņu no flakona adaptera iepakojuma. Pievienojiet adapteri pulvera flakonam, nospiežot uz leju, līdz gals iziet cauri gumijas aizbāzni un adapteris nofiksējas vietā.
2. Sagatavojiet pilnšļirci, ievietojot virzuli
3. Noņemiet pilnšļirces vāciņu. Pievienojiet šļirci pulvera flakonam, pieskrūvējot to pie adaptera.Pārnesiet visu šķīdinātāju uz pulvera flakonu.
4. Turot šļirci ievietotu adapterī, viegli virpiniet, līdz šķidrums ir dzidrs un tajā nav nešķīstošu daļiņu vai pulvera. Ja pulveris pielīp flakonam virs šķidruma virsmas, flakonu var nedaudz noliekt. Izvairieties no kratīšanas, lai novērstu puto.
Uz šķidruma virsmas ir pieļaujama mazu gaisa burbuļu gredzena veidošanās. Atšķaidīšanas procedūra parasti ilgst dažas minūtes, bet dažos gadījumos tā var ilgt pat 15 minūtes.
5. Pagrieziet flakonu otrādi un velciet līdz injekcijas šļirces marķējuma līnijai.
Vienmēr pārliecinieties, ka uzsūcat precīzu tilpumu un pielāgojaties gaisa burbuļiem.
6. Atvienojiet šļirci no adaptera un ievietojiet šļircē adatu dziļai zemādas injekcijai.
7. Ievadiet dziļu subkutānu injekciju. Lai to izdarītu: satveriet vēdera ādu, paceliet zemādas audus un dziļi ievietojiet adatu ne mazāk kā 45 grādu leņķī.
Tūlīt pēc izšķīdināšanas lēnām injicējiet 4 ml FIRMAGON 80 mg.
Injekcijas nedrīkst veikt vietās, kur pacients var tikt pakļauts spiedienam, piemēram, jostas zonā, kur ir joslas vai ribu tuvumā.
Neinjicējiet tieši vēnā. Viegli pavelciet šļirces virzuli atpakaļ, lai pārbaudītu, vai asinis ir iesūknētas. Ja šļircē ir asinis, zāles vairs nedrīkst lietot, pārtrauciet procedūru un izmetiet šļirci un adatu (izšķīdiniet pacientam jaunu devu).
Likvidēšanai nav nepieciešami īpaši noteikumi.
07.0 REĢISTRĀCIJAS APLIECĪBAS ĪPAŠNIEKS
Ferring Pharmaceuticals A / S
Kay Fiskers Plads 11
DK-2300 Kopenhāgena S
Dānija
08.0 REĢISTRĀCIJAS APLIECĪBAS NUMURS
EU/1/08/504/001
039232018
EU/1/08/504/003
09.0 PIRMĀJAS APLIECĪBAS VAI ATĻAUJAS DATUMS
Reģistrācijas datums: 17.02.2009
Pēdējās pārreģistrācijas datums: 19.09.2013
10.0 TEKSTA PĀRSKATĪŠANAS DATUMS
D.CCE 2014. gada novembris